|
|
电离平衡
|
水解平衡
|
|
实例
|
H2S水溶液(0.1 mol·L-1)
|
Na2S水溶液(0.1 mol·L-1)
|
|
研究对象
|
弱电解质(弱酸、弱碱、水)
|
强电解质(弱酸盐、弱碱盐)
|
|
实质
|
弱酸  H++弱酸根离子 H++弱酸根离子
弱碱 OH-+阳离子 OH-+阳离子
离子化速率=分子化速率
|
.jpg)
|
|
程度
|
酸(碱)越弱,电离程度越小多元弱酸
一级电离>二级电离
|
对应酸(碱)越弱,水解程度越大多元弱酸根
一级水解>二级水解
|
|
能量变化
|
吸热
|
吸热
|
|
表 达 式
|
电离方程式:①
②多元弱酸分步电离
H2S H++HS- H++HS-
HS- H++S2- H++S2-
|
水解离子方程式:①
②多元弱酸根分步水解
③产物一般不标“↑”或“↓”
S2-+H2O HS-+OH- HS-+OH-
HS-+H2O H2S+OH- H2S+OH-
|
|
粒子浓度
|
大小
比较
|
c(H2S)>c(H+)>c(HS-)>c(S2-)>c(OH-)
|
c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H2S)
|
|
电荷守恒式
|
c(H+)=c(HS-)+2c(S2-)+C(OH-)
|
c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)
|
|
物料守恒式
|
c(H2S)+c(HS-)+c(S2-)=0. mol-1
|
c(S2-)+c(HS-)+c(H2S)=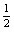 c(Na+)=0.1 mol·L-1 c(Na+)=0.1 mol·L-1
|
|
“H”守恒式
|
c(H+)=c(HS-)+2c(S2-)+c(OH-)
|
c(H+)+c(HS-)+2c(H2S)=c(OH-)
|
|
影响因素
|
温度
|
升温,促进电离,离子浓度增大
|
升温,促进水解
|
|
浓度
|
加水稀释
|
促进电离,离子浓度减小
|
促进水解
|
|
加入同种离子
|
抑制电离
|
抑制水解
|
|
加入能反应离子
|
促进电离
|
促进水解
|